 Régénération du latex et systèmes de transport membranaire chez les laticifères
Hevea brasiliensis.
Régénération du latex et systèmes de transport membranaire chez les laticifères
Hevea brasiliensis.
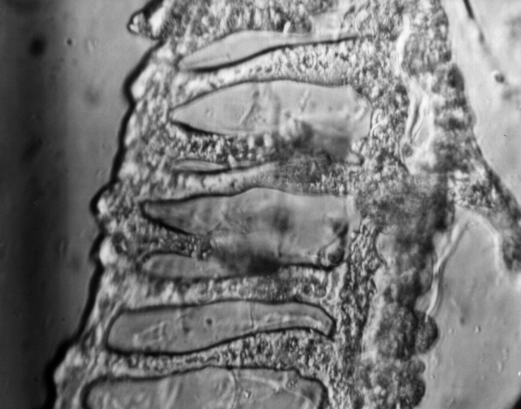
|
Protoplasts of laticiferous vessel network of Hevea brasiliensis (X600) isolated by enzymatic hydrolysis of the cell-wall. |
Téléchargez nos publications récentes au format PDF: HEVEA (916Ko).
Nous avons développé une approche cellulaire du
système responsable de la synthèse du caoutchouc : le laticifère. La culture de cette
plante, productrice de caoutchouc naturel, est d’une importance majeure pour
l’économie de nombreux états subtropicaux. Ce travail a été mené en étroite
collaboration avec l’équipe de J.L. Jacob du CIRAD-CP(Montpellier).
Ce travail a consisté à adapter des approches électrophysiologiques
à l'étude in situ et in vitro du laticifère, puis à analyser le fonctionnement d'un
certain nombre de transporteurs membranaires susceptibles d'être impliqués in planta
dans la régénération du latex qui suit la saignée du tronc, mode de récolte du
caoutchouc. Ce matériel original n'avait jusque là jamais été étudié par des
techniques électrophysiologiques, qui permettent d'accéder au fonctionnement des
transporteurs membranaires dans un environnement tissulaire.
Le réseau laticifère est constitué de cellules du phloème
anastomosées, peu vacuolées, dépourvues de plasmodesmes, et donc isolées du reste du
symplasme. Le fonctionnement des transporteurs de leur membrane plasmique revêt une
importance cruciale puisqu'il peut affecter la régénération du latex (ou cytosol) et
donc limiter la production de caoutchouc. En effet, la saignée du tronc engendre un
stress hydrique et osmotique important, dû à l’expulsion d’une partie du
latex. Le laticifère, pour régénérer son latex, devient alors un puits de première
importance pour l’absorption d’éléments tant minéraux qu’organiques.
Dans un premier temps nous nous sommes intéressés aux
mécanismes membranaires participant à l’absorption du saccharose, précurseur du
caoutchouc. Le saccharose est obligatoirement d'origine exogène car le laticifère ne
photosynthétise pas et ne possède pas de réserves de sucres.
Nous avons mis en évidence, par des techniques électrophysiologiques
et l'utilisation d’inhibiteurs spécifiques, l'effet dépolarisant de symports
H+/saccharose et/ou H+/glucose. Leur activité dépend de celle de la pompe à H+
plasmalemmique (modifiée par des inhibiteurs spécifiques ou des inhibiteurs
métaboliques). Ces résultats ont été confirmés à l'aide d'électrodes sélectives à
H+, qui ont permis de montrer que l'influx couplé de H+ et des sucres alcalinise
l'apoplasme (Bouteau et al. 1991). Par ailleurs, nous avons montré que l’éthylène,
hormone de stress connue pour favoriser la biosynthèse du caoutchouc, stimule l'activité
de la pompe à H+ des laticifères, et augmente le gradient de H+ favorable aux
cotransports (Bouteau et al. 1991). Cette hormone est couramment utilisée en plantation
pour augmenter la production.
L'électrogénicité des symports ne donnant pas d'indications
qualitatives sur l’absorption des sucres (déplacement d’une charge électrique
au travers de la membrane, couplé au transport du sucre neutre), nous avons vérifié,
grâce à des sucres marqués au 14C, que le laticifère excisé accumule le saccharose et
le glucose, comme celui de l'arbre intact. Pour vérifier la capacité du laticifère à
absorber le saccharose, et il a fallut écarter l'intervention possible d'une invertase
pariétale, et pour cela nous avons travaillé sur des protoplastes de laticifères. Nous
avons mis au point une méthode d'isolement des réseaux de laticifères par digestion
enzymatique. Leurs protoplastes sont atypiques: ils restent anastomosés en réseau, alors
que les protoplastes des autres cellules végétales sont classiquement sphériques et
séparés. Nous avons vérifié par autoradiographie que ce matériel original conserve la
capacité à absorber le 14C-saccharose, le 14C-fructose et le 14C-glucose. L'influx de
ces sucres étant sensible aux inhibiteurs du symport H+/saccharose (phloridzine), de la
pompe à H+ (vanadate) et aux protonophores (DNP), il est probable qu'il résulte du
fonctionnement de symports H+/sucres.
Des expériences complémentaires d’électrophysiologie ont permis
de confirmer l'intervention du symport H+/saccharose chez les protoplastes de laticifères
(Bouteau et al. 1993) et d'évaluer l'ordre de grandeur de sa constante d'affinité pour
le saccharose, soit environ 1 mM (Bouteau et al. 1999).
Nous nous sommes aussi intéressé aux systèmes membranaires
responsables des mouvements de K+, ion majeur du cytoplasme intervenant de façon très
précoce dans le processus de régénération du latex chez les arbres en exploitation.
Grâce aux électrodes sélectives au K+ et aux mesures de courants en voltage imposé
(système à mono-électrode), nous avons démontré la part prépondérante des flux de
K+ dans le maintien du potentiel de membrane, au repos, chez les laticifères dans le
tissu.
Chez les protoplastes, des courants K+ entrants et sortants ont pu
être enregistrés. Les premiers présentent des caractéristiques similaires à celles
observées pour les canaux K+ entrants rectifiants des autres cellules végétales :
activation en réponse à une hyperpolarisation de la membrane pour des concentrations de
KCl > 0,1 mM, dépendance vis-à-vis du temps, sensibilité au baryum et au
tetraéthylammonium (TEA), deux inhibiteurs de canaux K+. Le seuil d’activation de
ces canaux semble dépendre du potentiel d’équilibre du K+. Une telle régulation
fait que ces canaux ne s'ouvrent que lorsque les conditions (potentiel de membrane et
gradient de K+) autorisent l’absorption de K+. Elles sont réunies lorsque la
stimulation de la pompe à H+ hyperpolarise la membrane, permettant d'atteindre le seuil
d’activation de ces canaux et d'entraîner l'influx de K+ (Bouteau et al. 1996).
Les courants sortants présentent eux aussi des caractéristiques
comparables à celles des canaux K+ sortants rectifiants d'autres cellules végétales:
activation en réponse à une dépolarisation, dépendance vis-à-vis du temps,
sensibilité au baryum. Ces canaux semblent aussi être dépendants du Ca2+ cytosolique
(sensibilité au Ca2+ externe et à l'érythrosine B, bloqueur des pompes d'excrétion de
Ca2+) (Bouteau et al. 1996). Par contre, à la différence des autres cellules
végétales, les canaux K+ sortants des laticifères peuvent s’inactiver rapidement
dans certaines conditions (K+ interne faible). Cette caractéristique, associée à leur
seuil d’activation positif, suggère leur implication dans la perception et la
transduction d’un signal de type potentiel d’action (l’intervention d'un
tel signal est probable in planta après la saignée, car il est induit par les stress
mécaniques chez les plantes).
En conclusion : à la suite du stress de saignée, lors des
phases précoces de régénération du latex, la séquence d'intervention des différents
transporteurs membranaires des laticifères peut être envisagée comme suit : (i)
activation des canaux K+ sortants pour la régulation du potentiel membranaire, peut-être
en réponse à un signal de type potentiel d'action, (ii) stimulation de la pompe à H+
par l'éthylène endogène synthétisé en réponse à la blessure, (iii) influx de K+ via
les canaux K+ entrants et stimulation des symports H+/sucres, nécessaire à la synthèse
du caoutchouc, en réponse à l'hyperpolarisation due à la pompe à H+.







